Économiser sa salive : des solutions pour les patients sous clozapine

La clozapine est l'antipsychotique de référence dans la schizophrénie résistante, mais son utilisation peut être limitée par des effets secondaires parfois invalidants. Parmi eux, l'hypersialorrhée constitue un effet indésirable fréquent, touchant 30 à 80% des patients traités, avec une prédominance nocturne dans 85% des cas(1). Au-delà de la gêne physique voire psychologique qu'elle engendre, l'hypersialorrhée peut occasionner des complications physiques sévères allant des irritations cutanées péribuccales aux pneumopathies d'inhalation(2). Une étude récente révèle que 30% des patients sous clozapine rapportent un impact modéré à sévère sur leur qualité de vie(3). Plus préoccupant encore, une revue de 2015 identifiait l’hypersialorrhée et la constipation comme principales causes de décès associés à la clozapine(4).
Quoi de neuf ?
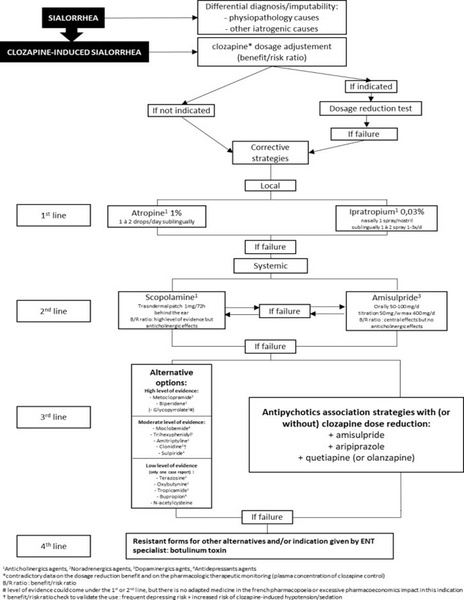
L'article de Rousseau-Voisin et al, publié dans L'Encéphale, propose la première revue systématique exhaustive des stratégies thérapeutiques disponibles en France pour gérer cette complication. Cette démarche répond à un besoin clinique concret : disposer d'un algorithme décisionnel adapté à notre pratique quotidienne. Les auteurs ont analysé 64 articles selon la méthodologie PRISMA, identifiant 17 substances utilisables en France parmi 19 stratégies globales recensées dans la littérature internationale.
Deux hypothèses physiopathologiques expliquent l’hypersialorrhée sous clozapine.
- La théorie muscarinique suggère que la clozapine, malgré son profil anticholinergique global, exercerait une stimulation sélective des récepteurs M4 dans les glandes salivaires, contrebalançant son antagonisme M3.
- La théorie adrénergique, elle propose quant à elle que le blocage des récepteurs alpha-1 et alpha-2 par la clozapine induirait une hyperstimulation compensatrice des récepteurs bêta-adrénergiques, majorant la production salivaire.
Ces hypothèses explicatives justifient la diversité des approches thérapeutiques testées. Les stratégies anticholinergiques constituent l'approche la plus documentée.
L'atropine en collyre à 1%, utilisée par voie sublinguale, bénéficie du plus haut niveau de preuve avec plusieurs essais contrôlés randomisés démontrant son efficacité. L'ipratropium en spray nasal à 0,03%, autre anticholinergique d'action locale, a montré une amélioration chez 80% des patients dans une série de dix cas suivis six mois(5). Ces traitements locaux présentent l'avantage majeur de limiter les effets systémiques, particulièrement la charge anticholinergique centrale qui pourrait aggraver les troubles cognitifs ou potentialiser la constipation induite par la clozapine. Le glycopyrrolate, bien qu'efficace dans les études internationales, pose problème en France où seules des formes galéniques inadaptées sont commercialisées.
Les traitements systémiques anticholinergiques de seconde ligne incluent la scopolamine, évaluée dans trois essais randomisés contrôlés. À la posologie de 0,3 mg par voie orale, elle s'est révélée bénéfique mais expose aux risques périphériques et centraux propres aux anticholinergiques. L'amitriptyline, antidépresseur tricyclique, a démontré une efficacité comparable à l'atropine dans un essai randomisé à des doses de 25 à 100 mg par jour, probablement via son action antimuscarinique(6). Le trihexyphénidyle et le bipéridène, anticholinergiques correcteurs traditionnels, ont montré des résultats modestes avec un profil de tolérance défavorable.
Les modulateurs dopaminergiques, représentés par les dérivés benzamides (amisulpride, sulpiride, métoclopramide), offrent une alternative pharmacologique intéressante. L'amisulpride, testé dans un essai randomisé contrôlé à 400 mg par jour, a réduit significativement les scores d'hypersialorrhée avec une bonne tolérance, bien que le risque d'hyperprolactinémie et de syndrome extrapyramidal limite son utilisation à long terme. Le métoclopramide présente un niveau de preuve solide avec 67% de patients répondeurs dans une étude randomisée versus placebo(7). Ces molécules agissent via un mécanisme antisécrétagogue périphérique comparable à celui observé au niveau gastrique.
Les stratégies noradrénergiques (clonidine, térazosine) reposent sur un rationnel pharmacologique moins établi et comportent des risques non négligeables, notamment le potentiel dépressogène de la clonidine et l'hypotension orthostatique majorée par la térazosine. La moclobémide, inhibiteur réversible de la MAO-A, a montré une efficacité de 84% dans une étude ouverte de 53 patients à 300 mg par jour, probablement via une action noradrénergique et sérotoninergique induisant une xérostomie(8). La N-acétylcystéine constitue une option innovante et bien tolérée, dont le mécanisme antioxydant reste à élucider.
Enfin, les injections de toxine botulique dans les glandes salivaires représentent l'ultime recours pour les formes réfractaires, avec une efficacité rapide et prolongée documentée dans plusieurs études, mais nécessitant l'intervention d'un spécialiste ORL.
Figure 1
Conclusion
Cette revue systématique apporte un éclairage précieux pour la pratique quotidienne en proposant un algorithme décisionnel pragmatique. L'approche recommandée privilégie en première intention une réduction prudente et progressive de la posologie de clozapine lorsque le rapport bénéfice-risque le permet, particulièrement si l'hypersialorrhée est apparue suite à une augmentation récente.
En cas d'échec ou d'impossibilité, les traitements anticholinergiques locaux (atropine sublinguale ou ipratropium nasal) constituent le premier choix thérapeutique, minimisant la charge anticholinergique systémique et ses conséquences potentiellement graves, notamment digestives et cognitives.
Les stratégies de deuxième ligne (scopolamine orale, amisulpride) et de troisième ligne (bipéridène, métoclopramide) doivent être réservées aux situations d'échec des approches locales, en évaluant scrupuleusement leur rapport bénéfice-risque individuel. La toxine botulique demeure l'option ultime pour les formes résistantes sévères.
Références
1. Bird, A. M., Smith, T. L., & Walton, A. E. (2011). Current treatment strategies for clozapine-induced sialorrhea. Annals of Pharmacotherapy, 45(5), 667-675.
2. Iqbal, M. M., Rahman, A., Husain, Z., Mahmud, S. Z., Ryan, W. G., & Feldman, J. M. (2003). Clozapine: a clinical review of adverse effects and management. Annals of Clinical Psychiatry, 15(1), 33-48.
3. Sanagustin, D., Martin-Subero, M., Hogg, B., Fortea, L., Gardoki, I., Guinart, D., ... & Valiente-Gómez, A. (2023). Prevalence of clozapine-induced sialorrhea and its effect on quality of life. Psychopharmacology, 240(1), 203-211.
4. Mustafa, F. A., Burke, J. G., Abukmeil, S. S., Scanlon, J. J., & Cox, M. (2015). “Schizophrenia past clozapine”: reasons for clozapine discontinuation, mortality, and alternative antipsychotic prescribing. Pharmacopsychiatry, 48(01), 11-14.
5. Calderon, J., Rubin, E., & Sobota, W. L. (2000). Potential use of ipatropium bromide for the treatment of clozapine-induced hypersalivation: a preliminary report. International clinical psychopharmacology, 15(1), 49-52.
6. Praharaj, S. K., & Arora, M. (2006). Amitriptyline for clozapine-induced nocturnal enuresis and sialorrhoea. British journal of clinical pharmacology, 63(1), 128.
7. Kreinin, A., Miodownik, C., Mirkin, V., Gaiduk, Y., Yankovsky, Y., Bersudsky, Y., ... & Lerner, V. (2016). Double-blind, randomized, placebo-controlled trial of metoclopramide for hypersalivation associated with clozapine. Journal of clinical psychopharmacology, 36(3), 200-205.
8. Kreinin, A., Miodownik, C., Libov, I., Shestakova, D., & Lerner, V. (2009). Moclobemide treatment of clozapine-induced hypersalivation: pilot open study. Clinical neuropharmacology, 32(3), 151-153.